Результаты сравнительного фармакоэкономического анализа стратегий профилактики реакции «трансплантат против хозяина» у детей с гемобластозами: опыт одного центра.
А.Б. АБРОСИМОВ, Д.С. БЛИНОВ, Е.В. БЛИНОВА, М.А. МАСЧАН
Ключевые слова: фармакоэкономический анализ, модель Маркова, клинико-экономическая эффективность, оценка затрат, реакция «трансплантат против хозяина», трансплантация гемопоэтических стволовых клеток, циклофосфамид, TCRa/b/CD19- деплеция, онкогематологические заболевания, дети.
Дискуссия вокруг стоимости аллогенной трансплантации гемопоэтических стволовых клеток и последующего наблюдения пациентов, методов расчета и структуры затрат, несмотря на широту применения трансплантации гемопоэтических стволовых клеток в онкогематологической практике, попрежнему остается нерешенной проблемой.
Осложняется дискуссия использованием разнообразных модификаций терапевтических опций в отношении подготовки пациента к операции и профилактики осложнений.
Целью данной статьи является сравнительная оценка клинико-экономической эффективности двух наиболее часто используемых технологических платформ – TCRαβ/CD19-деплеции и деплеции “in vivo” высокими дозами циклофосфамида на основе изучения особенностей каждого из этих методов в реальной практике одного центра.
Материалы и методы.
Для оценки были подобраны две “match paired” группы детей, которым была проведена трансплантация по одной из методик по поводу гемобластоза в период с мая 2013 г. по январь 2021 г. в ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России.
По полученным показателям клинической эффективности (достоверность различий выполнена с помощью непараметрического критерия Манна–Уитни) на основании модели Маркова проведено фармако-экономическое моделирование, определена структура затрат и выполнены фармако- экономический анализ «затраты–эффективность», инкрементальный анализ «затраты–эффективность», а также произведен расчет показателей стоимости операции через 5 лет с учетом дисконтирования.
В качестве конечных точек использованы результаты общей и бессобытийной выживаемости, а также выживаемости без развития реакции «трансплантат против хозяина» и рецидива.
Затраты разделены на 2 временных периода: 1-й этап – до 30-х суток после ТГСК и 2-й этап – с 31-х суток после ТГСК и до 1 года.
Расходы разделены на прямые и непрямые.
За непрямые расходы взяты средние цифры социально-экономических данных.
Результаты исследования.
Общие затраты для двух этапов были сопоставимы для обеих платформ: TCRa/b/CD19-деплеции – 6702,094 тыс. руб.; PtCy – 7325,661 тыс. руб.
Затраты неравномерно распределены по этапам: 1-й этап является более дорогостоящим для платформы TCR, 2-й – для PtCy. При анализе затраты–эффективность каждая единица эффективности (1% выживаемости за 1 год курации обходится дороже для платформы PtCy.
С учетом рекомендованного ВОЗ коэффициента дисконтирования в 3% за год за 5 лет годовая стоимость затрат для метода TCR должна снизиться до 5933,316 тыс. руб., а для платформы PtСy – до 6485,355 тыс. руб. без учета макро- экономических показателей.
Каждая дополнительная единица эффективности (1% выживаемости) TCR обойдется: для общей выживаемости в 311 783,50 руб., для бессобытийной выживаемости – в 207 855,67 руб., для выживаемости без РТПХ и рецидива – в 51 963,92 руб.
Выводы. Фармакоэкономически менее затратной за период 1 года курации оказывается превентивная платформа TCR по сравнению с платформой деплеции ‘’in vivo’’ с использованием высоких доз циклофосфамида, несмотря на более высокую стоимость ее применения на 1-м этапе курации.
Актуальность.
Аллогенная трансплантация гемопоэтических стволовых клеток (ТГСК) является одной из потенциально эффективных медицинских технологий в отношении онкогематологических заболеваний у взрослых и детей.
Вместе с тем ТГСК входит в десятку процедур с самым высоким ростом больничных расходов [7]. Чем более специализированной и ресурсоемкой является медицинская процедура, тем важнее понимать структуру расходов, заложенных в нее, давать им экономическую оценку, что позволит снижать затраты на проведение ТГСК.
В профессиональной среде имеются различные подходы к оценке стоимости как самого метода лечения, так и последующего ведения пациента ввиду высоких рисков развития посттрансплантационных осложнений, ведущим среди которых является реакция «трансплантат против хозяина» (РТПХ), которая, согласно международным данным, значительно увеличивает стоимость лечения [4, 9, 11].
Усложняют дискуссию и, соответственно, расчеты, используемые для профилактики РТПХ терапевтические платформы, выделение технологических этапов, необходимость учета этапа подготовки к операции так называемого предтрансплантационного этапа [4, 7, 9, 11].
В данной статье мы используем моноцентровый опыт использования двух наиболее популярных платформ для профилактики РТПХ как технологически ключевого звена для успешного проведения ТГСК.
Первой платформой является ex vivo автоматизированная иммуномагнитная сепарация клеток в функционально закрытой и стерильной системе – TCRa/b/CD19-деплеция трансплантата.
Данная технология обеспечивает более быстрое приживление трансплантата и достаточный эффект «трансплантат против лейкоза».
Одними из существенных лимитирующих факторов использования данной методики являются более поздняя иммунореконституция, высокая частота реактивации вирусных инфекций, в том числе цитомегаловирусной (ЦМВ) виремии [8, 10, 12]. Конкурирующей платформой служит in vivo деплеция с использованием высоких доз циклофосфамида в раннем посттрансплантационном периоде в сочетании со стандартной схемой профилактики РТПХ в виде использования микофенолата мофетила и такролимуса или циклоспорина А.
Данную методику отличают чуть более медленное приживление трансплантата, умеренная частота клинически зна- чимой РТПХ и высокая противоопухолевая активность.
Также данная технология демонстрировала ускоренные темпы иммунореконституции, низкую частоту реактивации вирусных инфекций [5, 6, 10, 13].
Обе платформы в российских реалиях имеют ключевое значение.
Это обусловлено широким использованием неполностью совместимых доноров в качестве реципиентов вследствие отсутствия полноценного национального регистра доноров костного мозга и низкого доступа отечественных клиник к международным базам неродственных доноров, отсутствием методов оплаты активации доноров из иностранных регистров в системе отечественного здравоохранения [2].
Данные проблемы делают дискуссию вокруг вышеозвученных платформ в профессиональной среде актуальной.
Особое значение имеет то, что в рамках наметившегося постепенного перехода российского здравоохранения к оплате медицинской помощи в рамках ценностно-ориентированного подхода учет расходов и клинико-экономическое сравнение двух базовых платформ профилактики РТПХ при проведении ТГСК позволят исследовать структуру расходов, их различие, выделить этапы оказания медицинской помощи пациентам именно с точки зрения фармакоэкономики, оценить клинико- экономическую эффективность методик и факторы, на них влияющие [1].
Цель исследования – на основании сравнительного фармакоэкономического анализа двух основных платформ профилактики «реакции трансплантат против хозяина» у детей с гемобластозами – TCRαβ/CD19-деплеции и деплеции “in vivo” высокими дозами циклофосфамида – установить клинико-экономические особенности каждого метода в условиях реальной клинической практики.
Материалы и методы исследования.
Ретроспективно были отобраны две группы пациентов детского возраста, получивших ТГСК по поводу онкогематологического заболевания высокого риска в период с мая 2013 г. по январь 2021 г. в ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России.
У первой группы (группа PtCy) пациентов (n = 39) была использована платформа профилактики РТПХ методом деплеции «in vivo» высокими дозами циклофосфамида на +3-и, +4-е сутки, среди ТГСК преобладали (n = 22) первые по счету операции, 7 трансплантаций были проведены повторно; тридцати пациентам была проведена ТГСК от гаплоидентичного донора, девяти – от неродственного HLA-совместимого донора.
Методом «match paired» данной группе из ретроспективной выборки была подобрана сопоставимая группа пациентов, у которых в качестве профилактики РТПХ применялась TCRa/b/CD19-деплеция трансплантата in vitro.
Подборка пациентов происходила по следующим параметрам: нозология, статус заболевания, номер ТГСК, период наблюдения и тип используемого донора.
Группа TCRa/b/CD19-деплеции была представлена 62 пациентами, из которых 47 перенесли первую ТГСК, 15 – повторную; га- плоидентичный донор использовался в 55 случаях, неродственный HLA-совместимый – в 7.
Предтрансплантационная подготовка включала протокольное миелоаблативное кондиционирование соответственно диагнозу, помимо циклофосфамида в первой группе для профилактики РТПХ использовалась классическая схема у 25 пациентов, у 12 пациентов по объективным причинам (мукозит, нарушение всасывания, нефротоксичность) данная схема претерпела изменения.
Во второй группе (группа TCR) – у 25 пациентов использовались ингибиторы кальциневрина, у 24 – препараты моноклональных антител (абатацепт, тоцилизумаб), 13 пациентов не получали никакой иммуносупрессивной терапии после ТГСК вследствие очень высокого риска рецидива.
На основании описания групп пациентов и полученных клинических результатов и событий, медианы массы пациентов (35 кг), медианной площади поверхности тела пациентов (1,1 м2) было выполнено фармакоэкономическое моделирование, основанное на модели Маркова [3].
Достоверность различий клинических эффектов определена с помощью непараметрического критерия Манна–Уитни.
По полученным моделям: модель пациента с использованием посттрансплантационного циклофосфамида (PtCy) и модель пациента с TCRa/b/CD19-деплецией (TCR) произведен расчет экономических затрат.
Расчет затрат производился на основании методики, установленной Приказом № 556 от 13 августа 2015 г. Минздрава России1, используемого для расчета стоимости протоколов клинической апробации методов профилактики, диагностики, лечения и реабилитации.
Все затраты разделены на непрямые и прямые: медицинские и немедицинские.
Проведен анализ «затраты–эффективность» методик профилактики РТПХ, в том числе с учетом ежегодного дисконтирования, инкрементальный анализ, для чего в качестве конечных точек использованы результаты общей и бессобытийной выживаемости, а также выживаемости без развития РТПХ и рецидива [4, 9]. Указанные типы фармакоэкономического анализа применены как ко всему периоду наблюдения, так и по двум его этапам.
Результаты проанализированы методами вариационной статистики.
Результаты исследования и их обсуждение.
Получены следующие клинические исходы, на основании которых проведены фармакоэкономическое моделирование и фармакоэкономический анализ.
Результаты представлены в табл. 1.
Таблица 1
Показатели клинической эффективности, примененные при фармакоэкономическом моделировании и проведении фармакоэкономического анализа
Как видно из полученных данных, в целом клинические результаты применения обеих платформ сопоставимы: общая и бессобытийная выживаемости пациентов составили: 58% и 53% соответственно для TCR и 56% и 50% соответственно для PtCy.
Однако обращает на себя внимание более медленное приживление трансплантата для платформы PtCy: лейкоцитов 20 дней, тромбоцитов 27 дней по сравнение с платформой TCR: 16 и 17 дней соответственно.
В свою очередь, это привело к увеличению медианы длительности госпитализации в асептическом боке, которая для группы PtCy составила 42 дня по сравнению с длительностью госпитализации в группе TCR – 30 дней, что отразилось в дальнейшем на прямых затратах.
Помимо длительности пребывания пациента в более затратном с экономической точки зрения отделении ТГСК обращает на себя внимание более высокий кумулятивный риск развития клинически значимой острой РТПХ 2–4-й стадий (42% против 21% в группе TCR, р = 0,28) и, в особенности, тяжелой острой РТПХ 3-4-й стадий для платформы PtCy (32% против 7% в группе TCR, р = 0,011), что нашло подтверждение и в показателе выживаемости без рецидива и РТПХ (GRFS), который составил для платформы PtCy 23% против 35% для платформы TCR.
С клинической точки зрения данные показатели отражают наличие серьезного осложнения у пациентов, связанное с ним снижение качества жизни, что привело к интенсификации курации данных пациентов, особенно спустя 30 суток после ТГСК, что требует больше прямых затрат на группу пациентов PtCy на более поздних этапах и подтверждается моделированием затрат.
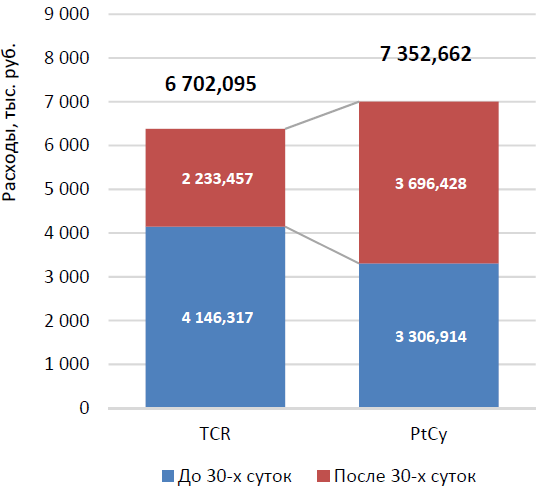
На рис. 1 представлено сравнение общих затраты в тысячах рублей за 1 год курации пациента по статьям расходов.
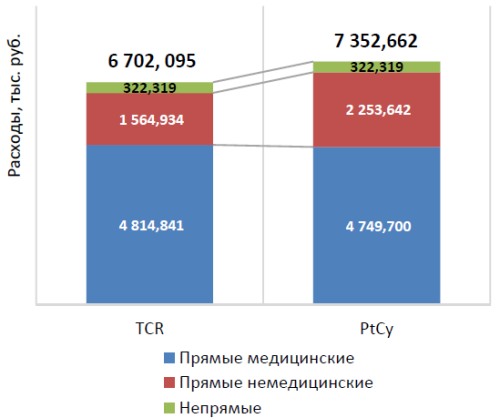
Очевидно, что более дорогостоящим является метод PtCy, в основном за счет прямых немедицинских расходов. Прямые медицинские расходы двух методик за период 1 года сопоставимы.
на одного пациента за 1 год курации согласно моделям TCR vs PtCy, тыс. руб.
При детальном рассмотрении общих затрат по этапам курации (рис. 2, 3) обращает на себя внимание, что стоимость курации пациента в рамках платформы PtCy выше после 30-х суток, тогда как до 30-х суток значительно более затратным является метод TCRa/b/CD19-деплеции.
Наибольший вклад в дороговизну платформы TCR вносят прямые медицинские расходы – 3 225,839 тыс. руб., отражающие высокую технологичность метода и высокую стоимость расходных материалов и самого процесса TCRa/b/CD19-деплеции.
Расходы метода PtCy распределены более равномерно во времени, прямые затраты на 1-м этапе невысокие за счет относительной простоты самой медицинской технологии.
Большая часть прямых затрат на 2-м этапе курации при использовании PtCy обусловлена более длительным пребыванием пациента в стационаре вследствие более медленного приживления трансплантата и потребности в пребывании в асептических условиях, развивающимися осложнениями, требующими длительного наблюдения и лечения, что вносит свой значительный вклад в удорожание метода именно на более позднем этапе.
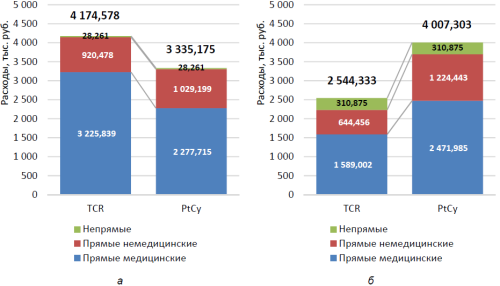
после ТГСК согласно моделям TCR vs PtCy, тыс. руб.

Таким образом, при клинической сопоставимости превентивных платформ экономические затраты на них отличаются: более высокая стоимость платформы TCR на 1-м этапе сменяется снижением затрат в дальнейшем, а затраты при использовании платформы PtCy остаются относительно высокими и на 2-м этапе.
Данный вывод подтверждается путем проведения фармакоэкономического анализа «затраты– эффективность» (табл. 2).
Таблица 2
Результаты анализа «затраты–эффективность», в том числе с учетом ежегодного дисконтирования на период 5 лет, инкрементального анализа «затраты–эффективность»
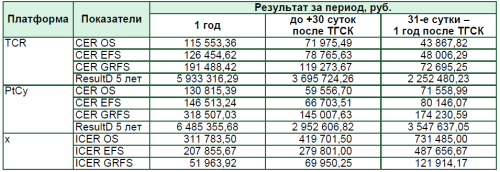
Как видно из представленных данных, каждая единица эффективности (1% выживаемости) обходится за 1 год курации:
- для платформы TCR: 115 553,36 руб. – для общей выживаемости; 126 454,62 руб. – для бессобытийной выживаемости; 191 477,42 руб. – для выживаемости без РТПХ и рецидива;
- для платформы PtCy: 130 815,39 руб. – для общей выживаемости; 146 513,24 руб. – для бессобытийной выживаемости; 318 507,03 руб. – для вы- живаемости без РТПХ и рецидива.
При этом из таблицы расчетов очевиден рост стоимости единицы эффективности для методики PtCy после +30 суток и, наоборот, снижения для методики TCR.
Таким образом, фармакоэкономически менее затратным за период 1 года курации оказывается превентивная платформа TCR по сравнению с платформой деплеции «in vivo» с помощью высоких доз циклофосфамида, несмотря на более высокую стоимость ее применения на 1-м этапе курации.
С учетом рекомендованного ВОЗ коэффициента дисконтирования в 3% за год за 5 лет годовая стоимость затрат для метода TCR должна снизиться до 5 933,316 тыс. руб., а для платформы PtСy – до 6 485,355 тыс. руб. без учета макроэкономических показателей.
Проведенный инкрементальный анализ «затраты–эффективность» экономически более выгодной платформы TCR показал, что каждая дополнительная единица эффективности (1% выживаемости) обойдется: для общей выживаемости в 311 783,50 руб., для бессобытийной выживаемости в 207 855,67 руб., для выживаемости без РТПХ и рецидива в 51 963,92 руб.
Выводы.
Обе превентивные относительно РТПХ платформы сопоставимы при оценке большинства показателей их клинической эффективности, однако лимитирующим фактором относительно платформы PtCy являлись показатели более высокого риска развития острой клинически значимой РТПХ 2–4-й стадий, в том числе тяжелой РТПХ 3-4-й стадий, что отразилось на ключевом для фармакоэкономического анализа показателе выживаемости без РТПХ и рецидива.
На наш взгляд, именно эти ключевые причины привели при оценке затрат к росту прямых расходов и, соответственно, общих затрат на курацию пациентов в группе PtCy по сравнению с таковыми в группе TCRa/b/CD19-деплеции за период 1 года курации при меньших инициальных затратах на саму технологию трансплантации в группе PtCy, что продемонстрировано на примере расчета затрат 1-го этапа курации.
Таким образом, показано, что платформа TCRa/b/CD19-деплеции является клинико-экономически более эффективной, чем платформа деплеции «in vivo» с использованием высоких доз посттрансплантационного циклофосфамида вследствие более высоких показателей клинической эффективности и более низких общих затратах на курацию пациентов в течение 1 года после ТГСК.
Возможно, что точечные изменения терапевтической стратегии в группе PtCy потенциально позволят снизить общие затраты на метод и сделать его более экономически и клинически эффективным.
Литература
- Концепция ценностноориентированного здравоохранения / Н.З. Мусина, В.В. Омельяновский, Р.В. Гостищев и др. // ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемио- логия. Т. 13(4). С. 438–451. DOI: https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.042.
- Онкогематологическая помощь взрослому населению в России: социально-экономическое исследование [Электронный ресурс]. URL: https://tinkovfund.org/research.
- Ягудина Р.И., Куликов А.Ю., Серпик В.Г. Фармакоэкономика. Ростов н/Д: Феникс, 237 c.
- Broder M.S., Quock T.P., Chang E. et al. The Cost of Hematopoietic Stem-Cell Transplantation in the United States. Am Health Drug Benefits, 2017, 10(7), pp. 366–374.
- Ciurea S., Zhang M-J., Bacigalupo A., Bashey A. Haploidentical transplant with posttransplant cyclophosphamide vs matched unrelated donor transplant for acute myeloid leukemia. Blood., 2015, 126, pp. 1033–1040. DOI: 10.1182/blood-2015-04-639831.
- Kleinschmidt K., Lv M., Yanir A., Palma J. et al. T-Cell-Replete Versus ex vivo T-Cell-Depleted Haploidentical Haematopoietic Stem Cell Transplantation in Children With Acute Lymphoblastic Leukae- mia and Other Haematological Malignancies. Front Pediatr., 2021, vol. 9, 794541. DOI: 10.3389/fped.- 794541.
- Majhail N.S., Mau L.W., Denzen E.M., Arneson T.J. Costs of autologous and allogeneic hema- topoietic cell transplantation in the United States: a study using a large national private claims database. Bone Marrow Transplant., 2013, 48(2), pp. 294–300. DOI: 10.1038/bmt.2012.133.
- Maschan , Shelikhova L., Ilushina M. et al. Outcome of αβ T cell-depleted transplantation in children with high-risk acute myeloid leukemia, grafted in remission. Bone Marrow Transplant., 2020, vol. 55(1), pp. 256–259. DOI: 10.1038/s41409-019-0531-3.
- Mayerhoff L., Lehne M., Hickstein L. et al. Cost associated with hematopoietic stem cell trans- plantation: a retrospective claims data analysis in Germany. J Comp Eff Res., 2019, vol. 8(2), pp. 121– DOI: 10.2217/cer-2018-0100.
- Pérez-Martínez , Ferreras C., Pascual A. et al. Haploidentical transplantation in high-risk pe- diatric leukemia: A retrospective comparative analysis on behalf of the Spanish working Group for bone marrow transplantation in children (GETMON) and the Spanish Grupo for hematopoietic transplantation (GETH). Am J Hematol., 2020, vol. 95(1), pp. 28–37. DOI: 10.1002/ajh.25661.
- Ricci , Jin Z., Broglie L. et al. Healthcare utilization and financial impact of acute-graft-versus host disease among children undergoing allogeneic hematopoietic cell transplantation. Bone Marrow Transplant., 2020, vol. 55(2), pp. 384–392. DOI: 10.1038/s41409-019-0688-9.
- Shelikhova L., Glushkova S., Nikolaev R. et al. Serotherapy-Free Regimen Improves Non-Re- lapse Mortality and Immune Recovery Among the Recipients of αβTCell-Depleted Haploidentical Grafts: Retrospective Study in Childhood Leukemia. Transplant Cell Ther., 2021, vol. 27(4), pp. 330.e1-330.e9. DOI: 1016/j.jtct.2021.01.010.
- Symons H.J., Zahurak M., Cao Y. et al. Myeloablative haploidentical BMT with posttransplant cyclophosphamide for hematologic malignancies in children and Blood Adv., 2020, vol. 4(16), pp. 3913–3925. DOI: 10.1182/bloodadvances.2020001648.
Источник: Абросимов А.Б., Блинов Д.С., Блинова Е.В., Масчан М.А. Результаты сравнительного фармакоэкономического анализа стратегий профилактики реакции «трансплантат против хозяина» у детей с гемобластозами: опыт одного центра [Электронный ресурс] // Acta medica Eurasica. – 2023. – № 1. – С. 1–10. – URL: http://acta-medica-eurasica.ru/single/2023/1/1. DOI: 10.47026/2413-4864-2023-1-1-10.